醫(yī)療器械CE認(rèn)證新法規(guī)MDR中引入了一些新的概念�,比如Basic UDI。Basic UDI是企業(yè)基于一定的編碼規(guī)則(比如基于GS1)�,自己規(guī)定的一類產(chǎn)品的代碼。這個(gè)代碼不會出現(xiàn)在產(chǎn)品上�����,但會出現(xiàn)在其他文件中����,比如:1.CE證;2.CE符合性聲明����;3.CE技術(shù)文件;4.SSCP;5.自由貿(mào)易證書等����。該法規(guī)將要求制造商,在歐盟境內(nèi)分銷的醫(yī)療器械標(biāo)識名為唯一器械標(biāo)識(UDI)特定代碼�����。
引言:醫(yī)療器械CE認(rèn)證新法規(guī)MDR中引入了一些新的概念�����,比如Basic UDI�����。Basic UDI是企業(yè)基于一定的編碼規(guī)則(比如基于GS1)���,自己規(guī)定的一類產(chǎn)品的代碼。這個(gè)代碼不會出現(xiàn)在產(chǎn)品上����,但會出現(xiàn)在其他文件中,比如:1.CE證����;2.CE符合性聲明���;3.CE技術(shù)文件;4.SSCP�����;5.自由貿(mào)易證書等���。該法規(guī)將要求制造商��,在歐盟境內(nèi)分銷的醫(yī)療器械標(biāo)識名為唯一器械標(biāo)識(UDI)特定代碼�����。
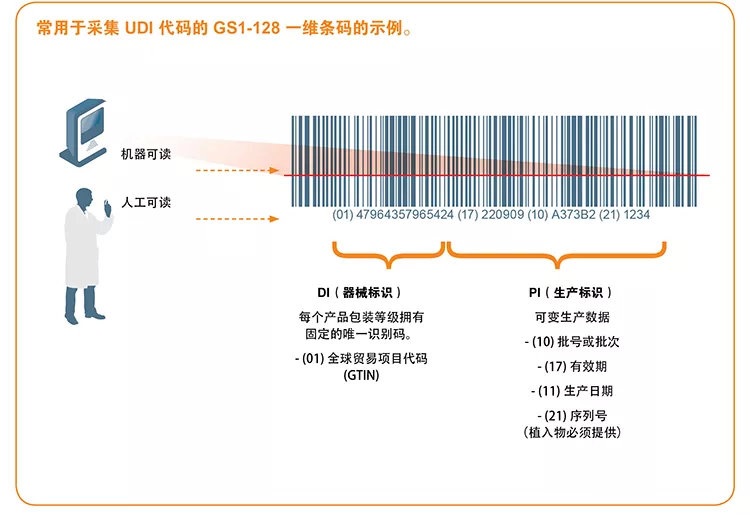
一��、什么是UDI編碼���?
UDI(唯一器械標(biāo)識)由固定器械標(biāo)識 (DI) 和可變生產(chǎn)標(biāo)識 (PI) 組成。UDI 必須提供人工可讀(純文本)和機(jī)器可讀兩種格式�����,后者使用自動識別與數(shù)據(jù)采集 (AIDC) 技術(shù)。
目前UDI 編碼只影響醫(yī)療器械類進(jìn)出口行業(yè)��,未來在中國是否會影響所有醫(yī)療器械行業(yè)��,還不確定���,但我國也在制作醫(yī)療器械唯一標(biāo)識系統(tǒng)規(guī)則(征求意見稿 )也許在不遠(yuǎn)的未來�����,也會在醫(yī)療器械中進(jìn)行UID打碼���。
二、UDI代碼應(yīng)在哪些領(lǐng)域應(yīng)用��?
一級或更高層次的醫(yī)療器械包裝上通常必須貼有 UDI 代碼���。集裝箱不屬于更高層次的醫(yī)療器械包裝。由于 GTIN(全球貿(mào)易項(xiàng)目代碼��,由 GS1 發(fā)布的標(biāo)識碼)對于每個(gè)層次的醫(yī)療器械包裝具有唯一性��,因此 UDI 代碼對于每一層次的包裝也具有唯一性�����。
例外情況:
1.如果一級包裝的標(biāo)識空間較有限,UDI 代碼可能會標(biāo)識在二級包裝上����。
2.對于獨(dú)立包裝的 I 類和 IIa 類一次性醫(yī)療器械,如醫(yī)用手套����,UDI 代碼可標(biāo)識在二級包裝上。
3.對于重復(fù)使用醫(yī)療器械�����,如手術(shù)器械��,除非直接標(biāo)識會對其安全或性能造成影響�����,或者在技術(shù)上不可行����,否則 UDI 代碼必須直接標(biāo)識在醫(yī)療器械本身上。
理論上所有聲稱符合MDR的產(chǎn)品��,都應(yīng)該有這個(gè)代碼。新法規(guī)要求聲稱符合MDR的所有產(chǎn)品���,CE符合性聲明中必須要包含有Basic UDI�����。據(jù)我司了解����,目前其他地區(qū)當(dāng)局也逐步開始要求此代碼���,如漢堡地區(qū)主管當(dāng)局�。
三�、Basic-UDI申請流程
Basic UDI可以在GS1網(wǎng)頁上自動生成。流程大致如下:
1.企業(yè)聯(lián)系GS1�,付費(fèi),成為會員�����,得到”GS1 Company Prefix”��。
2.獲得“Internal number”���。(注:此處不詳�,不確定是完全企業(yè)自己制定���,還是可以在GS1獲得���。)
3.把兩組數(shù)字輸入到以下網(wǎng)頁,點(diǎn)擊”Calculate”�,就會得到Basic UDI。
申請網(wǎng)址:https://www.gs1.org/services/gmn-generator