硬性光學內(nèi)窺鏡(自然孔道類)注冊產(chǎn)品是指通過人體自然孔道的方式進入人體的第二類觀察用硬性光學內(nèi)窺鏡產(chǎn)品�����,常見的硬性光學內(nèi)窺鏡(自然孔道類)包括喉鏡��、鼻竇鏡���、尿道膀胱鏡�、宮腔鏡��、直腸鏡等。今天為大家介紹硬性光學內(nèi)窺鏡(自然孔道類)產(chǎn)品技術要求及注冊審查要點����,一起看正文。
硬性光學內(nèi)窺鏡(自然孔道類)注冊產(chǎn)品是指通過人體自然孔道的方式進入人體的第二類觀察用硬性光學內(nèi)窺鏡產(chǎn)品�,常見的硬性光學內(nèi)窺鏡(自然孔道類)包括喉鏡、鼻竇鏡����、尿道膀胱鏡����、宮腔鏡、直腸鏡等�。今天為大家介紹硬性光學內(nèi)窺鏡(自然孔道類)產(chǎn)品技術要求及注冊審查要點,一起看正文���。
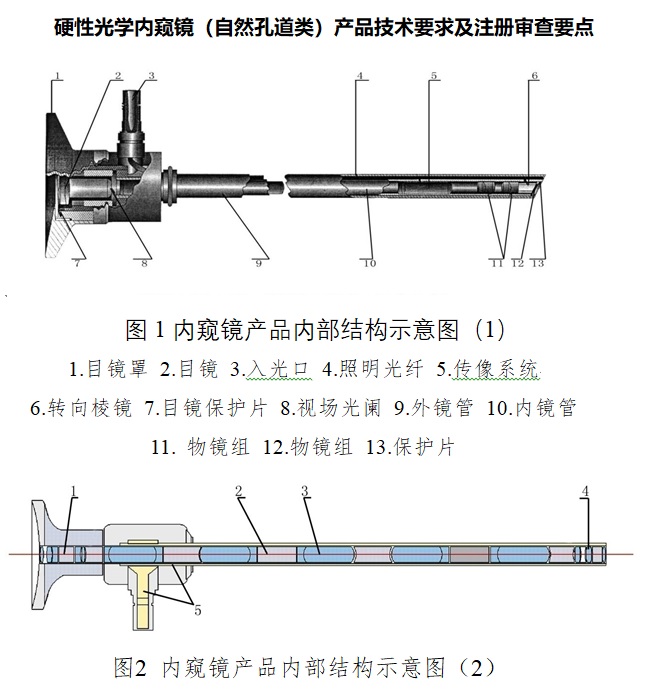
一�����、硬性光學內(nèi)窺鏡注冊單元劃分
硬性光學內(nèi)窺鏡(自然孔道類)注冊單元劃分應符合《醫(yī)療器械注冊單元劃分指導原則》的要求���,原則上以產(chǎn)品的技術原理��、結構組成���、性能指標和適用范圍為劃分依據(jù)。
一般情況下��,僅僅是長度��、直徑�����、視向角�����、視場角���、工作通道其中的一個或幾個參數(shù)有差異��,可以作為同一個注冊單元����,若內(nèi)窺鏡之間的差異超出上述范疇�,應考慮應劃分為不同的注冊單元��。
列舉如下:
(1)內(nèi)窺鏡有源或無源手術器械應與內(nèi)窺鏡劃分為不同的注冊單元����。
(2)不同適用范圍的內(nèi)窺鏡應劃分為不同的注冊單元���,如喉鏡��、鼻竇鏡��、尿道膀胱鏡�,原理����、結構基本無大變化���,每種產(chǎn)品作為一個注冊單元����。
(3)內(nèi)窺鏡與配合使用的設備(例如冷光源�����、攝像系統(tǒng)等)應劃分為不同的注冊單元。
(4)嵌入冷光源的內(nèi)窺鏡���、支持特殊光譜用于診斷或治療的內(nèi)窺鏡以及與上述典型內(nèi)窺鏡光學設計不同的內(nèi)窺鏡(如可變焦內(nèi)窺鏡�、短景深內(nèi)窺鏡和可變工作距內(nèi)窺鏡)等特殊內(nèi)窺鏡與普通內(nèi)窺鏡應劃分為不同的注冊單元��。
(5)成像方式不同的內(nèi)窺鏡應劃分為不同的注冊單元��。例如硬性光學鏡與硬性纖維鏡應劃分為不同的注冊單元��。
(6)是否有光學系統(tǒng)可作為注冊單元劃分的依據(jù)(如直腸鏡)����。一種產(chǎn)品只是含有導光束、窺視管等�,可提供光學照明,沒有光學系統(tǒng)�,不存在視場角、分辨率等的性能指標���;另外一種產(chǎn)品既含有光導束����,提供光學照明,又含有光學系統(tǒng)��,提供觀察和成像途徑�����,這兩種產(chǎn)品應作為兩個注冊單元���。
(7)一體式結構和分體式結構內(nèi)窺鏡(如宮腔鏡)�,他們的原(機)理���、結構����、主要性能���、預期目的基本相同����,可作為同一注冊單元的不同型號產(chǎn)品���。
本指導原則僅包括對于內(nèi)窺鏡的要求,可與內(nèi)窺鏡作為一個注冊單元的附件�����,根據(jù)具體情況提供相應的注冊申報資料。
二���、硬性光學內(nèi)窺鏡(自然孔道類)的工作原理
硬性光學內(nèi)窺鏡主要由光學成像系統(tǒng)和照明系統(tǒng)組成����。
完整的光學成像系統(tǒng)由物鏡系統(tǒng)��、傳像系統(tǒng)和/或目鏡系統(tǒng)三大系統(tǒng)組成��。工作原理:被觀察物經(jīng)物鏡所成的倒像�����,通過傳像系統(tǒng)將倒像以正像形式傳輸?shù)侥跨R�����,再由目鏡放大后���,為人眼所觀察�。為構成不同的視向角,需加入不同的棱鏡��。不同用途的內(nèi)窺鏡根據(jù)使用要求制作成不同的外形�、外徑、長度����,以達到使用所需的要求。
照明傳輸系統(tǒng)由光導纖維組成����。工作原理:將冷光源的光經(jīng)過光導纖維傳輸?shù)絻?nèi)窺鏡前端,照亮被觀察物�����。
三����、硬性光學內(nèi)窺鏡(自然孔道類)產(chǎn)品技術要求及檢驗報告
3.1申報產(chǎn)品適用標準情況
醫(yī)療器械注冊申請人需列表說明申報產(chǎn)品可參考的國家標準和行業(yè)標準,可參考標準詳見附2�����。
產(chǎn)品適用的標準應為現(xiàn)行有效版��,建議注冊申請人主動跟蹤相關標準的更新情況����。
3.2產(chǎn)品技術要求
產(chǎn)品技術要求需參照《醫(yī)療器械產(chǎn)品技術要求編寫指導原則》(國家藥品監(jiān)督管理局通告2022年第8號)文件進行編制??蓞⒖几?中適用標準,結合產(chǎn)品特征制定���,可分為性能要求�、電氣安全要求��、電磁兼容要求(若適用)等��。
3.3檢驗報告
注冊申請人應提供產(chǎn)品檢驗報告�,產(chǎn)品檢驗報告應符合國務院藥品監(jiān)督管理部門的要求,可以是醫(yī)療器械注冊申請人的自檢報告���,也可以是委托具有醫(yī)療器械檢驗資質(zhì)的醫(yī)療器械檢驗機構出具的檢驗報告��。
檢驗報告的產(chǎn)品名稱����、型號���、生產(chǎn)商等基本信息應與申報一致����。應明確檢驗依據(jù)和結論。性能部分應與技術要求中性能部分的要求表述一致��,安全部分應全面引用相關強制性標準�,依據(jù)產(chǎn)品的適用性出具完整報告。檢驗報告的照片頁應反映出產(chǎn)品結構組成�、基本外觀信息、銘牌信息��、重點結構和標識����。
如選擇典型性型號進行檢驗,應提交典型性聲明�,從產(chǎn)品風險與技術角度明確選擇典型性型號的依據(jù)。性能檢驗原則上可選擇同一注冊單元里視場角/視向角最大的��、插入部直徑最小的�����、細長比(長度/直徑)最大的型號����,如含有工作通道的�,直徑應為插入部外徑減去工作通道內(nèi)徑���;應選擇結構復雜的,特別是光學系統(tǒng)較復雜�����,容易出現(xiàn)薄弱環(huán)節(jié)的產(chǎn)品����。原因是基于以下例舉因素的考量:如視場角較大應注意視場邊緣的成像質(zhì)量;視向角比較大的情況需要驗證其成像效果�;細長比較大的情況對工藝的要求較高,需要驗證其光學和機械性能�����;有特殊結構設置的產(chǎn)品�,如可變視向角的內(nèi)窺鏡,需要對其特殊功能進行驗證等�。
由同一檢驗機構對性能、電氣安全進行檢驗的��,檢驗報告應進行關聯(lián),檢驗報告應備注樣品一致性以及產(chǎn)品整改情況�����。由不同檢驗機構出具對性能�、安全進行檢驗的,應按照《醫(yī)療器械注冊自檢管理規(guī)定》提交自檢報告及相應的申報資料��。
四���、硬性光學內(nèi)窺鏡(自然孔道類)注冊產(chǎn)品的生物學特性研究
生物學評價報告應體現(xiàn)產(chǎn)品名稱和型號��,與申報產(chǎn)品對應�����。內(nèi)窺鏡與人體接觸的材質(zhì)包括鏡頭����、鏡體以及膠水(如有)等���。應明確與人體接觸材料的部件名稱�����、材料名稱等信息�,提供圖示說明與人體接觸材料對應的位置。同時應考慮生產(chǎn)工藝及清潔滅菌對生物相容性的影響�,考慮設計生產(chǎn)過程中可能引入的污染物、殘留物����、降解產(chǎn)物�、加工殘留物影響等。
根據(jù)GB/T 16886.1的分類要求����,內(nèi)窺鏡預期與人體黏膜短期接觸,屬于表面接觸器械���。如需進行生物學試驗�����,通常應考慮細胞毒性����、致敏����、刺激或皮內(nèi)反應��,有可能接觸破裂或損傷表面的則不限于這三項�。應對生物學試驗情況進行概述����。生物學試驗可選取典型型號進行,說明典型型號選擇依據(jù)����。生物學試驗應最終產(chǎn)品上、或取自最終產(chǎn)品上有代表性的樣品上�、或與最終產(chǎn)品同樣方式加工(包括滅菌)的材料上進行。試驗樣品應根據(jù)注冊申請人制定的清潔����、滅菌方法進行處理。
如使用其他產(chǎn)品的生物學試驗報告���,應分析試驗產(chǎn)品對申報產(chǎn)品的代表性�����,就試驗產(chǎn)品與申報產(chǎn)品的差異性(材料來源或技術規(guī)范��、產(chǎn)品配方/工藝/初包裝或滅菌�����、運輸貯存條件���、預期用途�����、不良生物反應等)對生物相容性的影響進行評價,如評價資料不足以證明申報產(chǎn)品的生物相容性���,應重新開展生物學評價����。
與已上市產(chǎn)品相比����,如內(nèi)窺鏡中采用新的材料,應在評價資料中詳述其理化性能和生物學特性��。如豁免生物學試驗,可參考《關于印發(fā)醫(yī)療器械生物學評價和審查指南的通知》中的附2出具評價報告����。
對插入人體的金屬材料,若采用國家或行業(yè)標準中適用的醫(yī)用金屬材料�����,可不再重復生物學試驗����。注冊申請人應在生物學評價報告中標明所采用國家或者行業(yè)標準現(xiàn)行有效版本的標準號(含年號)及名稱,所選材料的牌號或/和代號��,以及材料的化學成分要求�����。金屬材料的化學成分應通過試驗來驗證��。
如有喉鏡�����、鼻竇鏡�����、尿道膀胱鏡、宮腔鏡��、直腸鏡等硬性光學內(nèi)窺鏡注冊咨詢服務需求��,歡迎您隨時方便與杭州證標客醫(yī)藥技術咨詢有限公司聯(lián)絡�,聯(lián)系人:葉工,電話:18058734169���,微信同�。